


转化医学和分子生物学的发展,揭示了肿瘤驱动性基因突变如何通过不同的信号通道传导机制促进肿瘤的发生和发展,为肿瘤靶向治疗开辟了道路,而紧随靶向治疗之后的耐药问题,也为肿瘤的靶向治疗管理提出了新的挑战。
目前,肿瘤管理往往基于分子诊断的证据基础制定最优的治疗策略。近期,发表在Current Oncology上的一篇综述文章Management of EGFR-mutated non-small-cell lung cancer: practical implications from a clinical and pathology perspective,以EGFR基因突变的非小细胞肺癌人群为核心,探讨EGFR突变NSCLC的治疗及第一、二代EGFR-TKI治疗后耐药机制问题,并提出一个可行的临床路径,帮助临床及病理医生制定最优治疗策略。
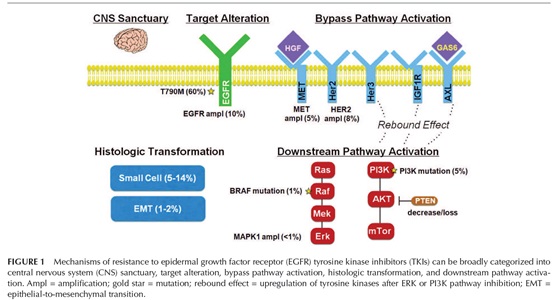
EGFR耐药机制可分为四大类:EGFR二次耐药突变、旁路激活、下游通道激活和组织转型;其中T790M突变是主要的耐药机制(约占60%),此外还有EGFR扩增(10%)、PIK3CA突变(5%)等;对耐药机制的研究推动了第三代EGFR-TKIs药物的开发,针对T790M突变的第三代EGFR-TKI奥希替尼与伴随诊断试剂同时获批上市。可见驱动性基因突变的确诊已彻底改变了非小细胞肺癌治疗体系。
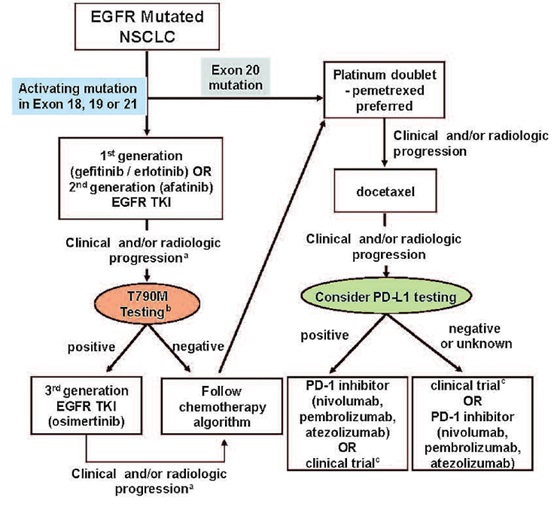
根据临床治疗方案的可行性,在不同阶段检测分别检测EGFR突变、T790M突变,或者考虑PD-L1检测,并以此来确定对应的治疗方案已成为EGFR突变NSCLC诊疗的新常态。而这一诊疗体系的建立中,分子诊断至关重要,不同阶段,选择具有明确临床治疗指导意义的基因进行诊断是基本策略。
所谓的具有明确的临床指导意义的基因是指该基因突变已有对应靶向治疗药物或者可指导临床治疗方案的确定。
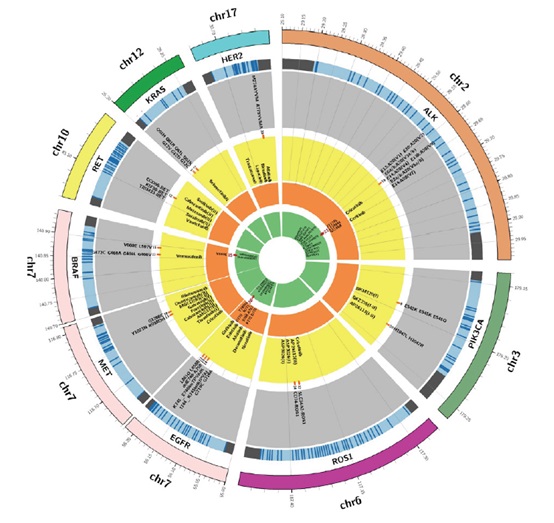
目前已知的肺癌驱动性基因有数十种,如上图所示,EGFR、ALK、ROS1基因突变已有对应的靶向药物获批上市, RET、MET、BRAF、PIK3CA、HER2等也有对应的靶向药物进入临床研究。